La técnica de edición genética CRISPR llega a la Cardiología
La manipulación genética, que comenzó a generar olas hace 30 años con la producción de cultivos transgénicos y la decodificación del genoma humano, hoy vuelve a las primeras planas de la mano de CRISPR, la revolucionaria técnica que permite “cortar y pegar” genes con una precisión nunca vista antes. Ahora, una empresa biotecnológica norteamericana planea utilizar CRISPR para tratar de raíz ciertas patologías cardiovasculares, como la insuficiencia cardíaca y la enfermedad coronaria. ¿Nacerá una nueva Cardiología?
La técnica de edición genética CRISPR-Cas9 se desarrollo en 2012 pero saltó a la fama en 2018, cuando el investigador chino He Jiankiu anunció que la había utilizado para crear mellizas con una mutación “beneficiosa” en el gen CCR5, que les conferiría resistencia a la infección por HIV. A pesar de que Jennifer Doudna, una de las creadoras de CRISPR, advirtió varias veces que la técnica no está lista para ser aplicada a seres humanos, muchos especialistas en fertilidad ya mostraron interés en el experimento de He.
De hecho, Shoukhrat Mitalipov, investigador en fertilidad de la Oregon Health and Sciences University (OSHU), en Estados Unidos, ya había intentado en 2017 editar in vitro la mutación MYBPC3 que causa miocardiopatía hipertrófica. El experimento mostró que es posible usar CRISPR para reparar mutaciones durante el proceso de fertilización artificial de embriones humanos sin generar mosaicismo, aunque algunos investigadores cuestionaron la metodología utilizada para editar los embriones (que no fueron implantados en ningún útero).
Ahora, Mitalipov vuelve a la carga con la edición genética de embriones antes de implantarlos. Después de todo, alega en Nature Medicine, hay más de 10.000 mutaciones monogénicas ligadas a enfermedades humanas. Y aunque la terapia genética de células germinales (GGT, por sus siglas en inglés) es un tema éticamente sensible, Mitalipov y sus colegas están dispuestos a explorarla sin remordimientos. “Dada la evolución del diagnóstico molecular de los desórdenes genéticos y nuestra habilidad para corregir los defectos genéticos en gametas, no es prematuro hacerlo”, polemizan Mitalipov y sus colegas.
Lo cierto es que la perspectiva de utilizar CRISPR desde estadios embrionarios tempranos para evitar enfermedades hereditarias e, incluso, para mejorar ciertos rasgos humanos, como la inteligencia, es un negocio que tienta a más de uno. Si bien la mejora de la especie humana está bastante lejos, la aplicación de CRISPR a la Cardiología es una realidad experimental.
La start up Verve Therapeutics recientemente reclutó al prestigioso cardiólogo y genetista Sekar Kathiresan, de la Universidad de Harvard, para desarrollar una terapia que disminuya el colesterol LDL por medio de la edición del gen de la enzima PCSK9, entre otros targets. No es el primer emprendimiento comercial de la terapia genética en el área cardiovascular pero probablemente será el más famoso.
Contra el colesterol LDL
Los primeros candidatos a tener sus células editadas por Verve son los pacientes con hipercolesterolemia familiar, una condición que afecta a 1 de cada 250 personas, según el Centers for Disease Control (CDC) de Estados Unidos, y que aumenta 13 veces el riesgo de enfermedad coronaria si no es tratada.
Por ahora, los investigadores de Verve no piensan inmiscuirse con células embrionarias. ”No editaremos ningún espermatozoide, ovocito o embrión. Sólo nos enfocamos en los adultos que puedan dar consentimiento informado para esta terapia experimental”, declaró Sekar Kathiresan, quien renunció no sólo a su silla de profesor en Harvard sino también a la dirección del Centro de Medicina Genómica del Massachussetts General Hospital para sumarse a la nueva empresa. Es cierto que no le faltaban razones científicas a Kathiresan para sumergirse en el desafío de la edición genética, pero tampoco carecía de razones personales. Después de todo, el hermano y el tío de Kathiresan, que padecían altos niveles de LDL, murieron por sendos infartos cardíacos antes de los 42 años.
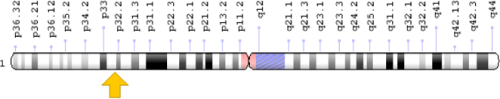
Gen de la enzima PCSK9, uno de los objetivos de la edición genética para evitar la enfermedad coronaria. Fuente: Verve Therapeutics.
El plan inicial de Verve incluye desarrollar en tres años un nanolípido que pueda inyectarse en la sangre del paciente y vehiculizar el sistema CRISPR-Cas9 al interior de las células del hígado. Allí, guiada por una especie de GPS molecular, la enzima Cas9 cortará una porción del gen PCSK9, silenciándolo.
Es interesante destacar que la edición genética que propone Verve se inspira en la existencia de personas que portan naturalmente una mutación que “apaga” la producción de la enzima PCSK9. Vale mencionar, también, que algo semejante es lo que actualmente hacen los biofármacos inhibidores de la PCSK9, que aumentan los receptores LDL en las células hepáticas al inhibir la producción de PCSK9.
Experimentos realizados en ratones ya mostraron que, al silenciar el gen en la mitad de las células hepáticas, se reduce significativamente el LDL circulante en sangre y, por consiguiente, disminuye el riesgo de infarto de miocardio. Los investigadores de Verve tienen que mostrar todavía resultados positivos en monos y voluntarios humanos para poder asegurar que su terapia génica funcionará en el contexto clínico. Pero dinero para hacerlo no les falta: Verve ya recibió inversiones de una empresa ligada a Google por 58,5 millones de dólares para llevar a cabo su objetivo.
Apuestas a futuro
En verdad, la terapia genética “convencional” se ensayó varias veces en el área cardiovascular con poco éxito, mayormente debido a la dificultad de integración de los vectores (generalmente, adenovirus) dentro de las células del corazón. Ahora, CRISPR podría cambiar el panorama. ¿Será posible eliminar la hipercolesterolemia con una sola inyección génica? ¿Será un tratamiento tan caro como el que se ofrece para la atrofia muscular espinal?
“Los avances en CRISPR son fabulosos; la edición génica hoy es mucho más eficiente y menos cara que la antigua terapia génica”, afirma el cardiólogo Santiago Miriuka, investigador del Conicet en el Laboratorio de Investigaciones Aplicadas en Neurociencias (LIAM) de FLENI. “Pero las barreras para aplicar CRISPR a la Cardiología todavía son enormes”, advierte el especialista en insuficiencia cardíaca.
“Es un gran desafío llegar a todas las células del corazón de un adulto con un vehículo que conduzca el sistema CRISPR-Cas”, explica Miriuka. “Además, si el corazón ya tiene fibrosis o está muy dilatado, la edición génica puede ser exitosa pero el pronóstico del paciente podría ser igualmente irreversible”, apunta el cardiólogo. Otro problema es que muchas enfermedades cardíacas, como la miocardiopatía hipertrófica, están causadas por varios genes y decenas de mutaciones, “por lo que habría que diseñar tratamientos específicos para cada paciente”, dice el investigador. ¿Será el verdadero triunfo de la medicina de precisión?
Por el momento, es preciso advertir que la terapia de edición genética tiene riesgos muy diferentes a los de los fármacos. No sólo puede generar mutaciones cancerígenas al generar reinserciones de ADN o eliminar algunas de las 3.000 millones de bases químicas que constituyen el genoma humano. La edición genética también puede provocar efectos adversos desconocidos a largo plazo. Hay que considerar, además, que sus efectos off-target no son reversibles. Si la edición se hace en células somáticas, el cambio será permanente pero no se heredará. En cambio, si CRISPR modifica de forma no deseada las células germinales de una persona, tendrá efecto sobre toda su descendencia.
La mutación de 32 bases generada por Hu Jenkiu en el gen CCR5 de las mellizas chinas, por ejemplo, puede disminuir su riesgo de contraer HIV/Sida e, incluso, mejorar su rendimiento cognitivo, según se ha sugerido recientemente. Pero un estudio realizado sobre la base de 400.000 genomas del UK Biobank acaba de revelar que quienes portan dos copias de la mutación Δ32 (delta 32), tienen 21% más probabilidad de morir en forma prematura que el resto, según publicaron investigadores de la Universidad de California en Berkeley en Nature Medicine. Esta mutación también aumenta el riesgo de complicaciones por influenza.
“Más allá de las cuestiones éticas involucradas en los bebés CRISPR, el hecho es que en este momento, con el conocimiento actual, es todavía muy peligroso intentar introducir mutaciones sin saber el efecto que producen”, declaró Rasmus Nielsen, profesor de Biología Integrativa y uno de los autores del estudio de la mutación CCR5-Δ32. Nielsen enfatiza que, por sus efectos deletéreos, “no es una mutación que la mayoría de la gente vaya a querer tener”.
Las autoridades sanitarias chinas anunciaron que implementarán regulaciones estrictas para impedir que su país se transforme en un paraíso de experimentos tipo GATTACA. Por su parte, destacados científicos occidentales hicieron un llamamiento a declarar una moratoria sobre la investigación humana con CRISPR en células germinales o embrionarias. Con todo, será difícil detener los experimentos disruptivos en células somáticas. Muchos expertos no ven impedimento hoy en utilizar CRISPR en órganos adultos, como el hígado y el corazón, y en células ex vivo. En cuanto a Shoukhrat Mitalipov, es uno de los pocos científicos que apoya editar genéticamente a los embriones humanos cuando está en juego una patología hereditaria.
Por lo pronto, la Universidad de Pennsylvania ya inició un protocolo de terapia génica para tratar con técnicas CRISPR ciertas células inmunitarias de pacientes con cáncer. La Universidad de Texas Southwestern también planea aplicar CRISPR al tratamiento de la distrofia muscular de Duchenne. Se está usando CRISPR, además, para modificarex vivo células de pacientes con anemias y , también, in vivo con un tipo de ceguera (amaurosis congénita), entre otros ensayos.
En la Argentina, Miriuka y sus colegas están aplicando CRISPR en un modelo de displasia arritmogénica del ventrículo derecho. “En nuestros experimentos in vitro, podemos diseñar cadenas de 20 bases de ADN para predecir una baja probabilidad de mutaciones off target. En los ensayos clínicos, no obstante, los niveles de seguridad tendrían que ser mayores”, desliza el cardiólogo de la SAC, quien anticipa que las primeras aplicaciones de CRISPR se verán en las talasemias y la hipercolesterolemia hereditaria.
Los fracasos de la terapia genética en el pasado obligan a los investigadores a ser extremadamente cautos, pero los expertos aseguran que los adelantos genéticos son vertiginosos. La posibilidad de eliminar enfermedades cardíacas mediante la técnica CRISPR atrae cada vez a más especialistas que buscan prevenir muertes prematuras en los pacientes adultos y, acaso, también en los seres humanos por nacer.
Por Alejandra Folgarait