Un nuevo enfoque para reparar el miocardio luego del infarto
Por el Dr. Horacio Fernández | Director del Consejo de Emergencias Cardiovasculares
Epicardial FSTL1 reconstitution regenerates the adult mammalian heart
Wei K, Serpooshan V, Hurtado C, et al.
Nature 2015; 525: 479-85 doi:10.1038/nature15372
Durante el desarrollo cardíaco (especialmente durante la gestación) el epicardio provee células progenitoras y estimuladores mitogénicos que promueven el crecimiento del miocardio. Los autores del trabajo que presentamos estudiaron en modelos animales cómo esas propiedades del epicardio podrían utilizarse para reparar y preservar la función de un miocardio dañado.
En la primera etapa de sus experimentos diseñaron parches con soporte de colágeno embebidos en sustancias generadas por células epicárdicas cultivadas, y los aplicaron sobre el epicardio de corazones de ratones con infartos experimentales. Observaron una mejoría en el remodelado y en la función ventricular (fracción de acortamiento) en comparación con controles a los que se les aplicó el mismo parche sin estar embebido en ese medio.
Identificaron a este mediador “cardiomiogénico” como el FSTL1 (follistatin like – 1), una glicoproteína que usualmente se eleva luego del infarto de miocardio, por lo que alguna vez se lo consideró como un marcador bioquímico de síndrome coronario agudo. Determinaron que durante la injuria miocárdica, su elevación se produce sobre todo en el miocardio sano, con ausencia de dicha elevación en el miocardio infartado y su epicardio, revelando una reacción de mala adaptación de la expresión de FSLT1 en el miocardio injuriado. Si bien el incremento del FSTL1 promueve la proliferación de miocitos, su tasa es insuficiente para compensar el daño del infarto.
Se plantearon la hipótesis de que incrementando los niveles de FSLT1 en el epicardio infartado traería beneficios en la recuperación ventricular.
Los autores sintetizaron FSTL1 humano mediante ingeniería recombinante con bacterias, verificando que in-vitro incrementa el número de los cardiomiocitos contráctiles y tiene propiedades anti-apoptóticas, sin producir hipertrofia ventricular.
Realizaron, siempre sobre ratones, experimentos utilizando parches de colágeno conteniendo FSLT1-humano recombinante con una duración de efecto de hasta 28 días. En simultáneo con un infarto experimental mediante la oclusión quirúrgica de la arteria descendente anterior, colocaban el parche sobre el área infartada. Este procedimiento demostró una mejoría en la sobrevida (ver figura), y la preservación de la función ventricular en forma sostenida en comparación con el grupo que no utilizó parche, como así también del que utilizó parche sin FSLT1-humano recombinante. Utilizando ratones modificados genéticamente para sobreexpresar FSLT1 también demostraron que la sola elevación del FSLT1 en el miocardio es insuficiente para producir beneficios, pero sí lo logra la administración local mediante parche de colágeno. En la histología se observó una menor fibrosis, y en la zona borde del infarto una mayor revascularización y un incremento de la división de miocitos con origen en cardiomiocitos inmaduros.
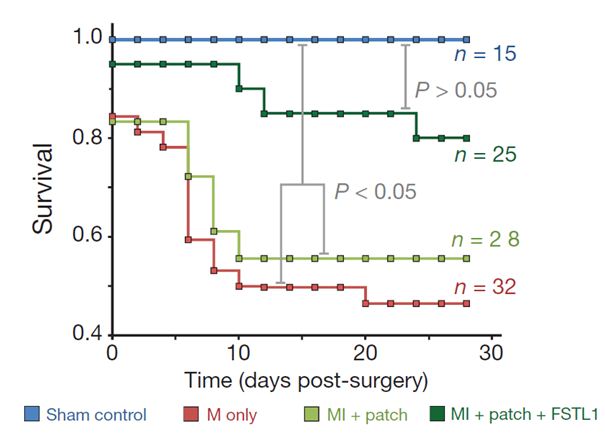
Observaron también similares beneficios cuando los parches con FSLT1-humano recombinante se colocaban una semana después del infarto experimental. Mientras que en los animales control infartados se observaba un deterioro progresivo de la fracción de acortamiento, en los tratados con el parche con FSLT1-humano recombinante este parámetro de función ventricular mejoraba en forma estable. Estos hallazgos sugieren que la administración epicárdica de FSLT1 es suficiente para lograr revertir la pérdida de miocardio viable aún tiempo después del infarto de miocardio experimental.
En una experiencia inicial con un modelo porcino con mediciones realizadas con RMN cardíaca, el parche con FSLT1 también sugiere beneficios terapéuticos que podrían trasladarse en el futuro a estudios clínicos en humanos.
Comentarios
Los cardiólogos ponemos día a día nuestro conocimiento y entusiasmo para prevenir, mitigar o revertir el daño causado por diversas enfermedades en el miocardio.
En el caso del infarto agudo de miocardio hemos aprendido a reperfundir a tiempo (angioplastia o trombolíticos), a indicar drogas para evitar la reoclusión (aspirina, inhibidores del receptor P2Y12, heparina), evitar el remodelado inadecuado (limitadores de la acción de la angiotensina, betabloqueantes y eplerenona); y cuando la función de bomba no llega a suplir las necesidades del organismo utilizamos inotrópicos, asistencia ventricular y hasta el trasplante cardíaco.
Cuando se pierden células contráctiles, la mejor terapéutica sería recuperarlas. Luego de los desalentadores resultados con el implante de células pluripotenciales, el estímulo a la división celular propuesto por Wei y Col. abre un nuevo horizonte. Además de proveer un soporte que evita la remodelación inadecuada, estos “parches” suturados al miocardio dañado podrían proveer FSLT1 y otras substancias que limiten el daño y promuevan la reparación del miocardio perdido.
¿Cuán lejos está la ciencia para que comencemos a utilizar estas tecnologías en humanos? ¿La única forma de colocar estos parches será la quirúrgica? ¿Podremos utilizarlos en la disfunción ventricular isquémica asociado a la revascularización con by-pass coronario? No podemos decirlo aún como cardiólogos clínicos. Pero entusiasma saber que hay investigadores básicos aportando nuevas ideas que nos ayuden con nuestra tarea de cuidar corazones.



